§15可做八种实验的《绿色化学实验管》(又名:多用实验管)
原创作者:江苏省徐州市科技中学 李 敏
(可以转载,但不能故意抹掉或假冒原创作者,不可剽窃核心内容发表或参赛。) 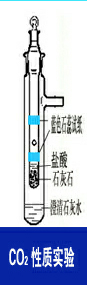
1 《绿色化学实验管》组成和工作原理
《绿色化学实验管》(如图1所示)全由玻璃制造,分为外管、内管和顶塞三部分。外管上有一个小支管,内管中部有一个小孔,内管插入外管里,形成既独立又连通的两个空间,向内放入不同的试剂,就可以简便快速、无污染地做二氧化碳的四个性质实验、铜片与浓硝酸反应实验,木炭与浓硝酸反应实验,硫化氢和二氧化硫的氧化还原反应实验、不用加热制取氨气和氯化氢气等实验。
2实验方法
2.1 CO2性质实验:(如图2所示)
向外管注入1~2ml澄清石灰水,在距内管气孔上下约1.5 cm处各缠绕一条湿润的蓝色石蕊试纸,向内管加入几粒石灰石碎块和稀HCI,盖上顶塞,二氧化碳从中部气孔排出,将内管插入外管。片刻石灰水出现白色混浊;随后内管气孔下部一条石蕊试纸先变红色,上部一条试纸后变红色;食指堵住支管口,拔下顶部活塞,插入燃烧的火柴,火柴熄灭。结论:
①通过石蕊试纸变红色,证明二氧化碳是酸性氧化物;
②二氧化碳能使澄清的石灰水变混浊;
③通过石蕊试纸变色顺序说明二氧化碳的密度比空气大;
④二氧化碳不能燃烧,且不支持燃烧。
化学反应方程式:
CaCO3+2HCl(稀) ==CaCl2+CO2↑+H2O
Ca(OH)2 +CO2==CaCO3↓+H2O
H2O +CO2 ==H2CO3
此实验验可让学生从另一角度认识二氧化碳的性质,实验时间在2min左右,教师可采用边实验边让学生练写化学方程式的方法,在课堂教学总结时做该实验,亦可作为探究型实验,生动活泼,方法新颖,定会给教学添写精彩一笔。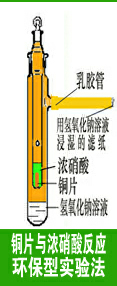
2.2 铜与浓硝酸反应环保型实验法:(如图3所示)
在外管的支管上套上5cm长的乳胶管,乳胶管内虚塞棉花或滤纸(切不可塞的太实,否则NO2将会逸出),棉花或滤纸用浓氢氧化钠溶液湿润。向外管中加入5mL氢氧化钠溶液,向内管中投入小片铜片,加入浓硝酸2mL,盖上顶塞。把内管插入外管中,铜与浓硝酸反应放出的红棕色二氧化氮气,从内管腰部的小孔排放出来,充满内、外管。NO2被外管下部的NaOH溶液和乳胶管棉花上的NaOH溶液吸收,有害气体不会外泄,保护了工作环境。(浓硫酸比NaOH溶液有更好地吸收能力,通常条件下,1体积的浓硫酸可吸收400体积的二氧化氮。若在外管内装浓硫酸实验效果会更好,不妨一试。)
化学反应方程式:
Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O
2NaOH+3NO2==2NaNO3+NO+H2O
 2NaOH+NO2+NO==2NaNO2+2H2O 2NaOH+NO2+NO==2NaNO2+2H2O
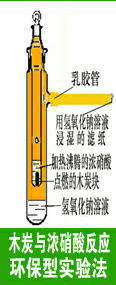
2.3 碳与浓硝酸反应环保型实验法:(如图4所示)
在外管的支管上套上5cm长的乳胶管,乳胶管内虚塞棉花或滤纸(切不可塞的太实,否则NO2将会逸出),棉花或滤纸用浓氢氧化钠溶液湿润。向外管中加入5mL氢氧化钠溶液,向内管中加入浓硝酸2mL,在酒精灯上加热,与其同时把花生米大小的木炭块点燃(用硬实的木炭),立即投入到内管热浓硝酸里,盖上顶塞。把内管插入外管中,木炭在热浓硝酸里激烈反应,上下跳跃,生成的红棕色NO2从内管腰部的小孔排出,充满内、外管。二氧化氮气体被外管下部的NaOH溶液和乳胶管棉花上的NaOH溶液吸收,有害气体不会外泄,保护了工作环境。
化学反应方程式:
C+4HNO3(浓) △== 4NO2↑ + CO2↑+2H2O
2NaOH+3NO2==2NaNO3+NO+H2O
2NaOH+NO2+NO==2NaNO2+2H2O
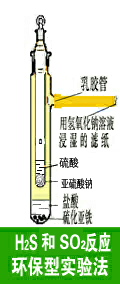 2.4 2.4 硫化氢和二氧化硫反应环保型实验法:(如图5所示)
在外管的支管上连接5cm长的乳胶管,乳胶管内虚塞棉花或滤纸,棉花或滤纸均用浓NaOH溶液浸透。内管放Na2SO3,外管放FeS,手指夹内管上部拉起一点,向外管里滴入盐酸(稍加热),产生硫化氢;再打开顶塞,向内管里滴入盐酸,盖上顶塞,产生的SO2从小孔排出。稍作振荡,管壁上迅速覆盖淡黄色的硫。实验时间2min左右,由于有NaOH溶液保护,所以能有效地防止有害气体外逸,保护了工作环境。管壁上的硫可用CS2洗涤清除。
化学反应方程式:
FeS+2HCl==FeCl2+H2S↑
Na2SO3+2HCl==2NaCl+SO2↑+H2O
2H2S+SO2==3S+H2O
2NaOH +H2S==Na2S++2H2O
 2NaOH+SO2==Na2SO3+H2O 2NaOH+SO2==Na2SO3+H2O
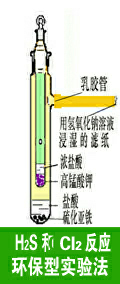
2.5 H2S
和Cl2反应环保型实验法:(如图5所示)
方法与"2 硫化氢和二氧化硫的氧化-还原反应"相似,内管加入固体KMnO4和浓盐酸产生Cl2 。外管加入FeS和HCl反应产生硫化氢。管壁上迅速覆盖淡黄色硫。管壁上的硫可用CS2洗涤清除。
化学反应方程式:
FeS+2HCl==FeCl2+H2S↑
2KMnO4+16HCl(浓) ==2KCl+MnCl2+5Cl2↑+8H2O
Cl2+H2S ==2HCl+S
2NaOH +H2S==Na2S++2H2O
2NaOH+Cl2==NaCl+NaClO+H2O
2.6 NH3和HCl气体的化合反应:
向外管里注入0.5mL浓氨水,向内管加入1ml浓盐酸,把内管插入外管里。摇荡一下多用实验管,氨气和氯化氢气体挥发出来,两种气体在管里发生化合反应,生成的白烟充满多用实验管。
化学反应方程式:HCl+NH3== NH4Cl
2.7 不加热快速制氨气:
外管加入5g左右固体NaOH,内管加氯化铵饱和溶液。当溶液滴到固体NaOH上,溶解时放出的热量替代了加热。NH3由支管导出。用加氯化铵溶液的多少控制NH3的产出量。若需大量NH3,可换成浓氨水滴入。此法可以快速制取大量NH3气,且不需加热,简单易行。
化学反应方程式:NaOH+NH4Cl==NaCl+NH3↑+ H2O
2.8 不加热快速制HCl气体:
外管加入浓硫酸,内管加浓盐酸,浓盐酸从内管小孔里流到浓硫酸上,浓硫酸密度大沉在下部,浓盐酸密度小浮在上部,初始没有明显反应,稍作振荡,HCl气体迅速生成,从外管上的支管排出。此法是利用浓硫酸的吸水性快速制取大量HCl气体,无需加热。
▲ 注意:实验方法中的1、2、3、4、5、6、适用于教师课堂演示实验;实验方法中的7、8适用于实验教师准备实验。
▲ 探究实验设想提示
1、 教材上设计的铜片与浓硝酸反应实验,生成的NO2收集在塑料袋里,没有最终处理办法,缺少环境保护思想。
2、 木炭与浓硝酸反应实验是典型的非金属与具有强氧化性酸反应的实验,教材重两次出现该问题(碳与浓硫酸反应),仅有化学反应方程式,而无实验,现在填补了这一空缺。
3、 硫化氢二氧化硫反应实验已被广大教师热烈讨论了多年,设计方案很多,但在仪器的紧凑性和环保问题上不尽人意,现在问题得到解决。
4、 用《绿色化学实验管》可增做氯气的多项实验:用胶布封闭内管上的小孔,把多条滤纸条缠绕其上,滤纸上滴上不同试剂(品红、溴化钠、碘化钠等)。外管里加入高锰酸钾固体和浓盐酸,立即把内管插入外管。支管处用含氢氧化钠溶液的棉花或滤纸吸收外逸的氯气。
上篇:§14安全准确地《检测电解质溶液导电性》
下篇:§16制取一氧化碳、氯气等气体时,分液漏斗里的酸液放不下来怎么办?
推荐:“实验误区”应细细研读。 &n |